公司新闻/正文
β-多肽的性质及研究现状
人阅读 发布时间:2019-04-26 14:59
β-氨基酸,又称作 3-氨基烷基羧酸,是指氨基连在羧酸的 β 位的氨基酸,除没有 β位的甘氨酸外,其余 19 种 α-氨基酸都有对应的 β-氨基酸。根据侧链在 β-氨基酸上的位置,β-氨基酸可分为 β3-,β2- 以及 β2,3-氨基酸,几种 β-氨基酸的化学结构如 Fig.1 所示。与 α-氨基酸相比,其在自然界中的含量并不丰富,主要是以游离或者与多肽绑定的形式存在。
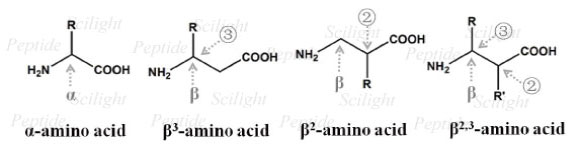
Fig.1 Chemical structures of α- and β-amino acids
顾名思义,β-多肽就是序列中含有 β-氨基酸的多肽分子,由于其具有极其重要的生物化学性质,在过去十多年中受到了比较广泛的关注,是研究最为彻底的多肽类似物之一。这类多肽的主要特性包括:i)长度较短的 β-多肽即能够以可预测的方式在溶液中进行折叠形成二级结构;ii)在多肽-蛋白质以及蛋白质-蛋白质相互作用中 β-多肽可用于模拟α-多肽;iii)对于多肽酶以及代谢转换稳定,故而在药物设计上占有重要的地位。
与常规 α-多肽相比,β-多肽的骨架要长,这也决定了其形成的二级结构与常规肽有很大差异。位于 α 位和 β 位的 β-氨基酸烷基侧链均利于 α-碳和 β-碳之间碳碳键采用反式构象,并对二级结构的热力学稳定性也产生显著影响。在 β-多肽折叠形成的多种有序二级结构(螺旋,折叠,转角等)中 [1],尤以其螺旋结构更吸引人的兴趣。大量研究表明,β-多肽可以形成比 α-多肽更为稳定、更加丰富的螺旋结构,根据其在溶液中形成的氢键环的原子数,可将这些螺旋结构分为 8-螺旋,10-螺旋,12-螺旋,14-螺旋,以及 10/12-螺旋等(如 Fig.2 所示)。一般来说,侧链为线型侧链的 β2- 和 β3-氨基酸残基易于使多肽形成 14-螺旋, β2/β3 氨基酸残基间隔排列的多肽则倾向于形成 10/12-螺旋结构,而环戊|烷以及环己|烷的环状侧链对构象产生位阻效应,会分别促使多肽形成 12-螺旋和 14-螺旋。这种特性使得通过控制 β-氨基酸的侧链基团来调控多肽形成的螺旋结构成为可能。

Fig.2 Different helical conformations named according to the H-bonding pattern
β-多肽丰富的二级结构使其广泛应用于多肽-蛋白质以及蛋白质-蛋白质相互作用的研究中。早在 1999 年 Seebach 等人 [2] 便发现 β-多肽(Fig.3 L)形成的发夹结构能够高强度高特异性地绑定生长抑素受体。JA Kritzer 等人 [3] 设计能够形成比较规整的 14-螺旋结构(Fig.3 R)的 β-多肽分子 β53-1,研究了这种多肽与蛋白质 hDM2 之间的特异性相互作用,发现其作用的强度以及特异性与 α-多肽几乎处于同一水平。大量研究工作证明 β-多肽还具有一系列其它功能,比如,Seebach 及同事 [4] 通过模拟载脂蛋白(apoliproteins)功能与 SRBI 受体蛋白进行绑定,从而对胆固醇及脂肪摄取产生抑制作用;DeGrado 等 [5] 发现双亲性的 β-多肽能够破坏细菌的细胞膜,具有高效的抗菌活性;Gellman 研究组 [6] 把 RNA 绑定蛋白 Tat 上一段转换为 β3-多肽从而设计了能与 TAR RNA 进行绑定的多肽,这种多肽能够打破 Tat 与 TAR 之间的绑定,有望应用于艾滋病的治疗。
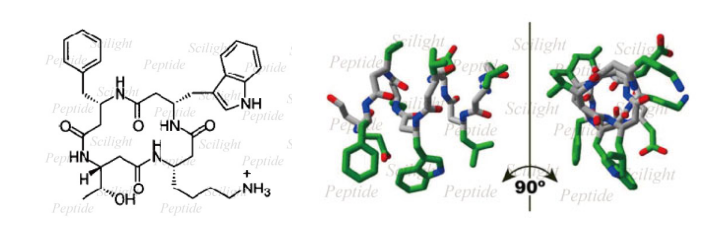
Fig.3 L) Cyclic peptidomimetic of somatostatin. R) NMR solution structure of β53-1 in CD3OH at 20°C, viewed from the side and down the helical axis.
蛋白质药物具有高活性、特异性强、低毒性、生物功能明确、有利于临床应用的特点,成为医药产品中的重要组成部分。β-多肽与 α-多肽相似的化学结构使其能够模拟多肽以及蛋白的性质,并往往能够起到改进药物疗效的作用;与此同时,β-多肽与 α-多肽在化学结构上的差异又使其可以抵抗生物体内蛋白酶的降解。比如,α-多肽作为抗生素药物是有非常有效的,但往往容易被患者体中的酶降解(蛋白质水解),而某些类型的β-多肽能够达到与 α-多肽相同的药用效果,其能抵抗蛋白水解的性质则为药物提供了更高的稳定性,这一性质也使其在新药开发领域备受关注。Horne WS 等 [7] 将 β-氨基酸引入到从 HIV 蛋白 gp41 中截取的多肽序列中,得到的 α-/β-多肽可用以模拟 gp41 关键亚单元的结构及功能,能够有效阻断 HIV-细胞的融入途径。其作用机理与传统的 gp41 衍生出的传统 α-多肽类似,但对于蛋白酶的降解具有更强的抵抗能力。这种利用 β-多肽的设计思路有望为药物设计提供一类具有丰富结构及生物活性多样性的候选药物分子。
北京中科亚光生物科技有限公司(http://www.scilight-peptide.com)秉持一贯的遵旨,紧跟科学前沿,通过多年的实验积累,优化合成条件和纯化工艺,可以充分满足客户的各种研发需求。如您有 β-多肽及其修饰或其他多肽定制服务方面的需求,欢迎来电来函咨询,我们将以最大的热忱为您服务!
【参考文献:】
1.a) Seebach D, Abele S, Gademann K, Jaun B. Pleated Sheets and Turns of β-Peptides with Proteinogenic Side Chains. Angew. Chem. Int. Ed., 1999, 38: 1595. b) Krauthäuser S, Christianson LA, Powell DR, Gellman SH. Antiparallel Sheet Formation in β-Peptide Foldamers: Effects of β-Amino Acid Substitution on Conformational Preference. J. Am. Chem. Soc., 1997, 119: 11719. c) Chung YJ, Cristianson LA, Stanger HE, Powell DR, Gellman SH. A β-Peptide Reverse Turn that Promotes Hairpin Formation. J. Am. Chem. Soc., 1998, 120: 10555.
2.Gademann K, Ernst M, Hoyer D, Seebach D. Synthesis and Biological Evaluation of a Cyclo-Beta-Tetra-Peptide as a Somatostatin Analogue. Angew Chem, Int Ed., 1999, 38: 1223.
3.Kritzer JA, Stephens OM, Guarracino DA, Reznik SK. β-Peptides as inhibitors of protein–protein interactions. Bioorganic & Medicinal Chemistry, 2005, 13: 11.
4.Werder M, Hauser H, Abele S, Seebach D. Beta-Peptides as Inhibitors of Small-Intestinal Cholesterol and Fat Absorption. Helv Chim Acta., 1999, 82: 1774.
5.a) Hamuro Y, Schneider JP, DeGrado WF. De Novo Design of Antibacterial β-Peptides. J Am Chem Soc., 1999, 121: 12200. b) Liu DH, DeGrado WF. De Novo Design, Synthesis, and Characterization of Antimicrobial Beta-Peptides. J Am Chem Soc., 2001, 123: 7553.
6.Gellman MA, Richter S, Cao H, Umezawa N, Gellman SH, Rana TM. Selective Binding of TAR RNA by a Tat-Derived Beta-Peptide. Org Lett., 2003, 5: 3563.
7.Horne WS, Johnson LM, Ketas TJ, Klasse PJ, Lu M, Moore JP, Gellman SH. Structural and Biological Mimicry of Protein Surface Recognition by Alpha/Beta-Peptide Foldamers. PNAS, 2009, 106: 14751.
地址:北京市丰台区科学城海鹰路 7 号大恒科技大厦四层 邮编:100070
电话:010-62810190/85 传真:010-62818544 QQ:564774988/2101981825
E-mail: marketing@scilight-peptide.com
Web: www.scilight-peptide.com

Fig.1 Chemical structures of α- and β-amino acids
顾名思义,β-多肽就是序列中含有 β-氨基酸的多肽分子,由于其具有极其重要的生物化学性质,在过去十多年中受到了比较广泛的关注,是研究最为彻底的多肽类似物之一。这类多肽的主要特性包括:i)长度较短的 β-多肽即能够以可预测的方式在溶液中进行折叠形成二级结构;ii)在多肽-蛋白质以及蛋白质-蛋白质相互作用中 β-多肽可用于模拟α-多肽;iii)对于多肽酶以及代谢转换稳定,故而在药物设计上占有重要的地位。
与常规 α-多肽相比,β-多肽的骨架要长,这也决定了其形成的二级结构与常规肽有很大差异。位于 α 位和 β 位的 β-氨基酸烷基侧链均利于 α-碳和 β-碳之间碳碳键采用反式构象,并对二级结构的热力学稳定性也产生显著影响。在 β-多肽折叠形成的多种有序二级结构(螺旋,折叠,转角等)中 [1],尤以其螺旋结构更吸引人的兴趣。大量研究表明,β-多肽可以形成比 α-多肽更为稳定、更加丰富的螺旋结构,根据其在溶液中形成的氢键环的原子数,可将这些螺旋结构分为 8-螺旋,10-螺旋,12-螺旋,14-螺旋,以及 10/12-螺旋等(如 Fig.2 所示)。一般来说,侧链为线型侧链的 β2- 和 β3-氨基酸残基易于使多肽形成 14-螺旋, β2/β3 氨基酸残基间隔排列的多肽则倾向于形成 10/12-螺旋结构,而环戊|烷以及环己|烷的环状侧链对构象产生位阻效应,会分别促使多肽形成 12-螺旋和 14-螺旋。这种特性使得通过控制 β-氨基酸的侧链基团来调控多肽形成的螺旋结构成为可能。

Fig.2 Different helical conformations named according to the H-bonding pattern
β-多肽丰富的二级结构使其广泛应用于多肽-蛋白质以及蛋白质-蛋白质相互作用的研究中。早在 1999 年 Seebach 等人 [2] 便发现 β-多肽(Fig.3 L)形成的发夹结构能够高强度高特异性地绑定生长抑素受体。JA Kritzer 等人 [3] 设计能够形成比较规整的 14-螺旋结构(Fig.3 R)的 β-多肽分子 β53-1,研究了这种多肽与蛋白质 hDM2 之间的特异性相互作用,发现其作用的强度以及特异性与 α-多肽几乎处于同一水平。大量研究工作证明 β-多肽还具有一系列其它功能,比如,Seebach 及同事 [4] 通过模拟载脂蛋白(apoliproteins)功能与 SRBI 受体蛋白进行绑定,从而对胆固醇及脂肪摄取产生抑制作用;DeGrado 等 [5] 发现双亲性的 β-多肽能够破坏细菌的细胞膜,具有高效的抗菌活性;Gellman 研究组 [6] 把 RNA 绑定蛋白 Tat 上一段转换为 β3-多肽从而设计了能与 TAR RNA 进行绑定的多肽,这种多肽能够打破 Tat 与 TAR 之间的绑定,有望应用于艾滋病的治疗。

Fig.3 L) Cyclic peptidomimetic of somatostatin. R) NMR solution structure of β53-1 in CD3OH at 20°C, viewed from the side and down the helical axis.
蛋白质药物具有高活性、特异性强、低毒性、生物功能明确、有利于临床应用的特点,成为医药产品中的重要组成部分。β-多肽与 α-多肽相似的化学结构使其能够模拟多肽以及蛋白的性质,并往往能够起到改进药物疗效的作用;与此同时,β-多肽与 α-多肽在化学结构上的差异又使其可以抵抗生物体内蛋白酶的降解。比如,α-多肽作为抗生素药物是有非常有效的,但往往容易被患者体中的酶降解(蛋白质水解),而某些类型的β-多肽能够达到与 α-多肽相同的药用效果,其能抵抗蛋白水解的性质则为药物提供了更高的稳定性,这一性质也使其在新药开发领域备受关注。Horne WS 等 [7] 将 β-氨基酸引入到从 HIV 蛋白 gp41 中截取的多肽序列中,得到的 α-/β-多肽可用以模拟 gp41 关键亚单元的结构及功能,能够有效阻断 HIV-细胞的融入途径。其作用机理与传统的 gp41 衍生出的传统 α-多肽类似,但对于蛋白酶的降解具有更强的抵抗能力。这种利用 β-多肽的设计思路有望为药物设计提供一类具有丰富结构及生物活性多样性的候选药物分子。
北京中科亚光生物科技有限公司(http://www.scilight-peptide.com)秉持一贯的遵旨,紧跟科学前沿,通过多年的实验积累,优化合成条件和纯化工艺,可以充分满足客户的各种研发需求。如您有 β-多肽及其修饰或其他多肽定制服务方面的需求,欢迎来电来函咨询,我们将以最大的热忱为您服务!
【参考文献:】
1.a) Seebach D, Abele S, Gademann K, Jaun B. Pleated Sheets and Turns of β-Peptides with Proteinogenic Side Chains. Angew. Chem. Int. Ed., 1999, 38: 1595. b) Krauthäuser S, Christianson LA, Powell DR, Gellman SH. Antiparallel Sheet Formation in β-Peptide Foldamers: Effects of β-Amino Acid Substitution on Conformational Preference. J. Am. Chem. Soc., 1997, 119: 11719. c) Chung YJ, Cristianson LA, Stanger HE, Powell DR, Gellman SH. A β-Peptide Reverse Turn that Promotes Hairpin Formation. J. Am. Chem. Soc., 1998, 120: 10555.
2.Gademann K, Ernst M, Hoyer D, Seebach D. Synthesis and Biological Evaluation of a Cyclo-Beta-Tetra-Peptide as a Somatostatin Analogue. Angew Chem, Int Ed., 1999, 38: 1223.
3.Kritzer JA, Stephens OM, Guarracino DA, Reznik SK. β-Peptides as inhibitors of protein–protein interactions. Bioorganic & Medicinal Chemistry, 2005, 13: 11.
4.Werder M, Hauser H, Abele S, Seebach D. Beta-Peptides as Inhibitors of Small-Intestinal Cholesterol and Fat Absorption. Helv Chim Acta., 1999, 82: 1774.
5.a) Hamuro Y, Schneider JP, DeGrado WF. De Novo Design of Antibacterial β-Peptides. J Am Chem Soc., 1999, 121: 12200. b) Liu DH, DeGrado WF. De Novo Design, Synthesis, and Characterization of Antimicrobial Beta-Peptides. J Am Chem Soc., 2001, 123: 7553.
6.Gellman MA, Richter S, Cao H, Umezawa N, Gellman SH, Rana TM. Selective Binding of TAR RNA by a Tat-Derived Beta-Peptide. Org Lett., 2003, 5: 3563.
7.Horne WS, Johnson LM, Ketas TJ, Klasse PJ, Lu M, Moore JP, Gellman SH. Structural and Biological Mimicry of Protein Surface Recognition by Alpha/Beta-Peptide Foldamers. PNAS, 2009, 106: 14751.
地址:北京市丰台区科学城海鹰路 7 号大恒科技大厦四层 邮编:100070
电话:010-62810190/85 传真:010-62818544 QQ:564774988/2101981825
E-mail: marketing@scilight-peptide.com
Web: www.scilight-peptide.com